Autores:
- Aron Gonshor PhD, DDS, FRCD(C); Conferencista, Universidad McGill, Departamento de cirugía oral y maxilofacial, Montreal, Quebec, Canadá.
- Chris L Tye MD, DDS; consulta privada en cirugía maxilofacial, Colleyville, Texas, EE. UU.
Las extracciones ocurren principalmente como resultado de caries, traumatismo o enfermedad periodontal. La caries es endémica y una causa predominante de pérdida dental en la población norteamericana, con la enfermedad periodontal siendo responsable del 30-35% de las extracciones en personas mayores de 40 años de edad. Clínicamente es importante reemplazar los dientes faltantes con la opción más adecuada para el paciente, y la preservación de la cresta y el sitio al momento de la extracción es crítica para el éxito a largo plazo, sin importar el procedimiento usado para el reemplazo dental.
Las técnicas actuales para la preservación de la cresta y el sitio incluyen el uso de materiales de injerto óseo y/o membranas reabsorbibles. Idealmente, al final del proceso el área se llenará con hueso vital mineralizado con mínimo o ningún material de injerto óseo restante.
Se han usado una variedad de materiales para el injerto óseo en conectores, con el propósito de preservación de la cresta. Esto incluye las mezclas óseas de partículas de hueso recuperadas de donador (autoinjertos), aloinjertos y partículas de xenoinjertos, así como materiales sintéticos. Se ha encontrado que el uso de membranas de titanio sobre conectores de extracción -con o sin el uso de injertos de hueso autógeno- favorece la preservación de la cresta. Se ha usado el hemihidrato de sulfato de calcio sintético de grado médico y se ha encontrado que se reabsorbe completamente a los 3 meses y es capaz de permitir el crecimiento de nuevo hueso trabecular.
El hueso bovino anorgánico se puede usar y ha demostrado ser seguro y efectivo. Un estudio llenó conectores con hueso bovino anorgánico y luego cubrió los conectores con injertos gingivales libres, recolectados con una punción de tejido blando. Se encontró que los injertos gingivales tenían un área integrada media de 99.7% a los 6 meses. Se realizó un análisis visual del tejido blando cicatrizando. También se han usado derivados de hueso bovino en la regeneración ósea tanto para la preservación del conector y en los defectos periodontales intraóseos, cuando se usaron solos, o en combinación con plasma rico en plaquetas -con y sin regeneración tisular guiada, y con derivados de matriz de esmalte.
Se ha encontrado que el material óseo poroso bovino, en combinación con membranas de colágeno usadas para regeneración tisular guiada en la extracción de sitios de conector, resulta en mayor llenado óseo del conector a los 6 meses que usando materiales óseos bovinos con fibrinógeno/fibronectina autólogos en vez de membrana de colágeno. Un estudio reciente comparó el uso de hueso bovino desproteinizado (Blo-Oss®, Osteohealth Co., Shirley, NY, EE.UU.), frente al uso de la membrana sola durante la colocación inmediata del implante. Mientras que los niveles óseos se mantuvieron para ambos grupos, los márgenes de tejido blando fueron más coronales y por lo tanto más favorables estéticamente en el grupo tratado con tanto el material de injerto óseo y la membrana reabsorbible. El estudio concluyó que en los defectos óseos periimplante, el hueso desproteinizado era capaz de evitar el colapso del tejido blando blando superficial en el defecto; un abordaje muy beneficioso en áreas estéticas.
El presente estudio mira los resultados del uso de un mineral óseo bovino anorgánico (ABBM) llamado NuOss™ (ACE Surgical Supply Co., Brockton, EE.UU.) como un material de injerto en conectores alveolares humanos postextracción.
MATERIALES
Mineral óseo bovino anorgánico -NuOss™ El hueso generalmente se puede dividir en dos regiones: cortical y esponjosa. El hueso cortical tiene una densidad mayor que el hueso esponjoso, debido principalmente a la diferencia en los poros distribuidos en la estructura ósea. El hueso esponjoso es una estructura más porosa, teniendo grandes poros distribuidos a través del hueso. El componente orgánico del hueso representa el 40% del contenido óseo, principalmente de colágeno tipo I (99%), con componentes menores de glicoproteínas ácidas, fosfoproteínas, proteínas morfogénicas óseas (BMP) y otras minorías no colagenosas (1%). El componente inorgánico del hueso está compuesto de minerales de base calcio de estructura de apatita, principalmente de apatita de carbonato, conteniendo pequeñas cantidades de magnesio, sodio, potasio, cloruro, etc.
Se ha demostrado que la parte orgánica del hueso se puede eliminar sin alterar significativamente la estructura nativa del mineral óseo. Se ha desarrollado un método que puede crear este hueso anorgánico, mientras mantiene la estructura del mineral similar al del hueso nativo. Este hueso anorgánico, NuOss™ (esponjoso y cortical), es comercializado por ACE Surgical Supply Co. (Brockton, MA, EE.UU.), y procesado por Collagen Matrix, Inc. (Franklin Lakes, NJ, EE.UU.).
NuOss™ es derivado de vacas originarias de los Estados Unidos de Norteamérica y nunca ha habido un caso reportado de encefalopatía espongiforme bovina (BSE) transmitida a ningún dispositivo médico derivado de tejido bovino. Este ABBM es aislado y purificado del hueso del fémur de vacas menores de 30 meses de edad, usando una metodología patentada. La porción esponjosa viene de la cabeza del fémur y la porción cortical del eje del fémur. Esencialmente el método consiste en un proceso de extracción química y tratamiento calórico para retirar los componentes orgánicos del hueso resultando en un mineral óseo bovino anorgánico, una sal de fosfato de calcio natural en una estructura de apatita de carbonato.
Los atributos físicos y químicos de este hueso anorgánico se determinaron por una serie de estudios de caracterización in vitro.
Caracterización física
Determinación del tamaño de poro: se tomaron microfotografías electrónicas de barrido a varios aumentos (software Image J, NIH). El tamaño del poro se definió como la distancia más grande a través de un solo poro.
Área de superficie interna: usando un método de porosimetría de nitrógeno, se expresó el área como metro cuadrado por gramo de mineral (m2/g).
Capacidad de vacío (capacidad de llenado de volumen): el llenado de volumen por unidad de peso de mineral óseo está relacionada con el espacio vacío disponible para realizar crecimiento interno celular y nueva deposición ósea, expresada en unidad de cm3/g.
Caracterización química
El índice de fosfato de calcio (proporción Ca/P): se determinó el calcio por espectrofotometría de absorción atómica usando un analista PerkinElmer 100 (PerkinElmer, Waltham, Mass, EE.UU.), y fosfato usando molibdato ácido/acetona como reactivo. Se leyó la absorbancia de fosfato usando un espectrofotómetro Spectronic 21D (Milton Roy, Ivyland, Penn, EE.UU.).
MÉTODOS CLÍNICOS
El estudio se realizó durante el periodo de agosto de 2006 a agosto de 2007. Hubo 10 pacientes en esta serie de casos, 6 mujeres y 4 hombres, con una edad promedio de 53 años (42-61). Tres pacientes tuvieron fractura dental, dos tuvieron tratamiento endodontivo fallido y los cinco restantes tuvieron caries extensas. Todos los pacientes se sometieron a extracción dental, después de haber otorgado el consentimiento escrito y oral. En 8 pacientes se usó el 1er o 2do molar, cinco en el arco inferior y tres en el superior. En todos los molares extraídos se separaron las raíces. En los 2 pacientes restantes fue un diente incisivo superior. El criterio de inclusión fue el siguiente: a) hueso: hueso bucolingual ancho en la unión cemento-esmalte (CEJ) de al menos 4mm, dehiscencia de hueso facial por debajo del margen de tejido blando/CEJ no mayor a 5 mm. B) tejido blando: ancho bucolingual en la CEJ de al menos 2 mm, altura facial-apical por debajo de la CEJ de no más de 5 mm.
El criterio de exclusión fue fumar, diabetes, o enfermedad autoinmune, absceso con inflamación de tejidos blandos, bifosfonatos orales, extracciones quirúrgicas que requirieran la extracción de más de 2 mm de hueso crestal bucal y dehiscencia ósea bucal de más de 5 mm de tejido blando.
Se realizó extracción atraumática bajo anestesia local. Se examinó el conector para encontrar desechos residuales y determinar si la cantidad de sangrado era apropiada. Se empaquetó entones el material de injerto ABBM en el conector hasta el nivel del hueso crestal para asegurar la regeneración ósea máxima. Se colocó una cinta de colágeno de acción corta o tapón (ACE Surgical Supply Co., Brockton, MA, EE.UU.), para cubrir el mineral óseo, y una sutura de larga acción Vicryl® (Johnson and Johnson, Langhorne, PA, EE.UU.) tanto de forma colchonero horizontal y en forma de ocho. Se administró al paciente un enjuague de clorhexidina (0.25%) por el periodo de 1 semana después de la operación. No se administraron antibióticos. Para los pacientes que se sometieron a extracción molar, no se usó prótesis durante la fase de cicatrización. En el caso de la extracción de diente incisivo se colocó un puente fijo temporal.
Biopsias centrales
En la cita de colocación del implante, en promedio 6 meses después de la colocación del injerto, se elevó un colgajo, y se tomó una biopsia de núcleo óseo con 2.7 mm de diámetro interno (3.5 mm de diámetro externo) de trefina. Estos núcleos óseos cilíndricos se dejaron dentro de la trefina y se colocaron en formalina amortiguada neutral al 10% para su fijación.
Preparación histológica
Todas las preparaciones histológicas se realizaron en la universidad de odontología Baylor, Dallas, Texas, EE.UU. y en la universidad McGill en Montreal, Quebec, Canadá. En la recepción, se deshidrató las muestras con una serie graduada de alcohol por nueve (9) días. Las muestras fueron entonces infiltradas con una resina encapsuladora de curado ligero. Después de otros veinte (20) días, se encapsuló y se polimerizaron las muestras con luz de 450 nm. Se preparó entonces las muestras por el método de corte/molido de Donath y Rohrer. Los núcleos fueron entonces pulidos a un grosor de 45-65 μm, seguido de un pulido final con 0.3 micrones de pasta pulidora de aluminio. Las laminillas fueron teñidas con hematoxilina-eosina y cubiertas en la parte superior para su análisis histológico por medio de evaluación de campo brillante y microscopía polarizada.
Histomorfometría
Después de la preparación histológica no descalcificada, los núcleos fueron evaluados morfométricamente. Los núcleos fueron digitalizados al mismo aumento usando Leica DMR HC y una cámara digital Jenoptic ProgRes C14.
Se realizaron las mediciones histomorfométricas usando Bioquant Nova Prime Bone Morphometry versión 6.50.10 (Bioquant Image Analysis Corp. – Nashville, Tenn, EE.UU.). Los parámetros evaluados fueron el área total del núcleo, el porcentaje de formación de hueso nuevo, y el porcentaje de material de injerto residual. El remanente del área se consideró como de tejido blando, vacío u osteoide. La laminilla primaria evaluada para cada muestra fue de la región más central del núcleo obtenido.
RESULTADOS
- Material
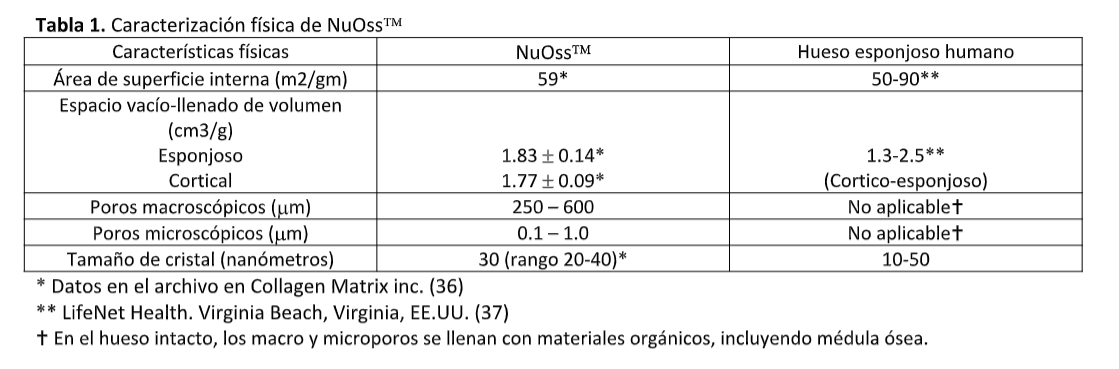
Los resultados generales para NuOss™ se resumen en las Tablas 1 y 2.
El área de superficie interna es similar para NuOss™ y para hueso esponjoso humano (retirando la médula ósea), indicando que el espacio disponible para depósito de hueso nuevo también debería ser similar (Tabla 1). El área de superficie interna es una prueba frecuente de porosidad, usando una metodología de absorción de nitrógeno. Un indicador aún mejor de espacio disponible para el crecimiento de hueso es la medición del espacio vacío: el espacio no ocupado por mineral óseo. El espacio vacío se calcula midiendo el volumen (cm3) ocupado por 1 gramo de material de injerto óseo y sustrayendo el volumen ocupado por el mineral por sí mismo, lo cual indica el espacio disponible para el crecimiento de osteoblasto. El hueso poroso/cortical humano, en el rango de tamaño de partículas de 250-100μ, normalmente ocupará 1.3-2.5 cm3/g. El mineral óseo poroso NuOss™ ocupa 2.83 cm3/g.El hueso cortical NuOss™ ocupa 1.77 cm3/g. Esto indica que tanto el hueso humano y NuOss™ son muy similares en su capacidad de proporcionar una matriz con suficiente espacio vacío disponible para el crecimiento de osteoblastos y formación de hueso nuevo. La similitud en el tamaño del cristal entre NuOss™ y hueso poroso humano indica que se espera que ambos materiales tengan características de resorción y remodelación similar.
La Tabla 2 muestra las características químicas de este ABBM. Para determinar el contenido residual de proteína, si es que existe, se realizó un análisis de contenido de nitrógeno residual en el producto mineral anorgánico. El contenido promedio de nitrógeno para 9 lotes aleatorios de productos producidos en un periodo de tiempo de cerca de 12 meses fue 0.007 +/- 0.001%. Asumiendo el contenido promedio de nitrógeno en proteína es de 13.6% p/p (peso promedio de nitrógeno en todos los aminoácidos + peso promedio molecular de todos los aminoácidos), el contenido residual de proteína en NuOss es de 0.06 +/- 0.01%.
El índice Ca/P confirma que NuOss™ tiene un contenido mineral altamente puro, evidenciado por la presencia mínima de materiales orgánicos residuales y una cercana similitud al del hueso esponjoso humano sometido a procesamiento similar. Además, la composición química de este mineral anorgánico es fosfato de calcio natural en una estructura de apatita de carbonato (5%), aproximándose al evidenciado en hueso esponjoso humano (7.4%).
- Histología
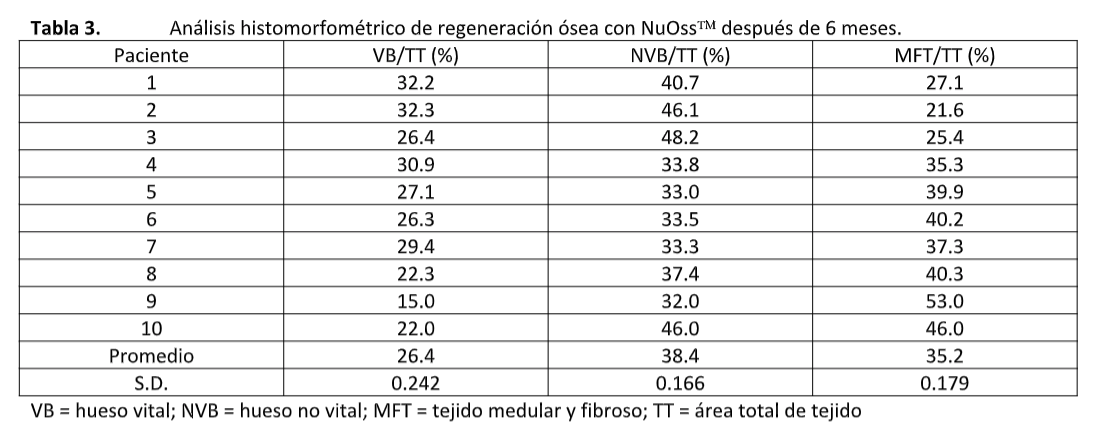
La evaluación histomorfométrica de los 10 casos se resume en la Tabla 3. Indican un contenido óseo vital promedio de 26.4 (rango de 15-32%) y un contenido de injerto residual de 38.4 (rango de 32-48%) después de un tiempo de recuperación promedio de 6 meses. La inspección de las secciones apical y coronal de los núcleos no mostró diferencias significativas en el contenido óseo entre estas dos áreas.
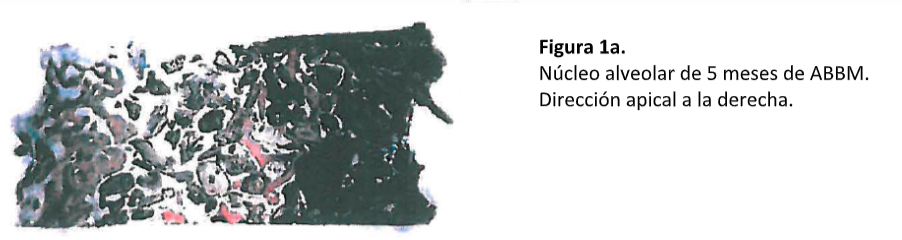
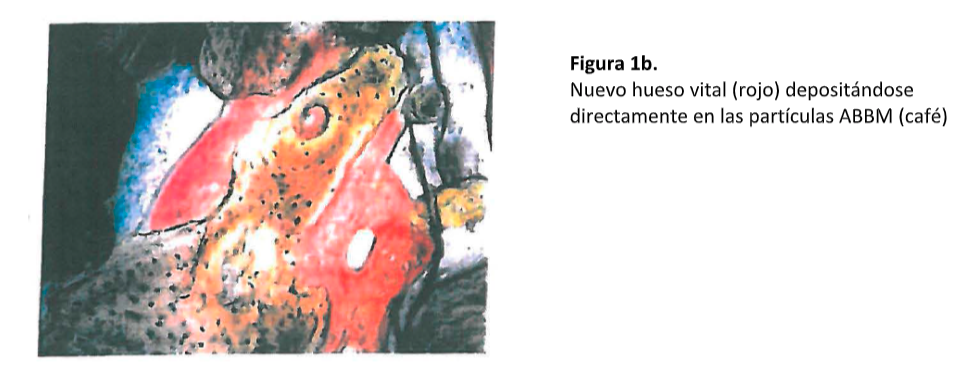
Se puede observar un ejemplo representativo de la evidencia histológica en la serie de imágenes en la Figura 1. En la Figura 1a se muestra una imagen a bajo aumento de un núcleo alveolar tomada 5 meses después de la colocación de ABBM. La dirección apical está hacia la derecha. Hay amplia evidencia de infiltración ósea (rojo) en la región del hueso injertado (café). El remanente del área consiste principalmente de tejido conectivo. Una vista a gran aumento de la porción de la imagen previa muestra aposición de hueso vital directamente en las partículas de ABBM (Figura 1b). Es importante notar que el hueso huésped está en íntimo contacto con las partículas ABBM, sin encapsulación fibrosa de este ABBM. Además, hay “puenteo” de las partículas por el nuevo hueso formado – un signo cardinal de integración dinámica del material de injerto en el ambiente de hueso huésped. En la Figura 1c hay un área de hueso nuevo formado con osteoblastos rodeando el hueso.
DISCUSIÓN
Cuando un paciente presenta la necesidad de injerto óseo, el material de elección ha sido tradicionalmenteel propio hueso del paciente. Hay una gran variación de la opinión sobre qué materiales se deben usar para diversos procedimientos clínicos, la justificación de su uso, y cómo los materiales de injerto deben combinarse, dado que uno busca tener materiales que posean la tríada de potencial osteogénico (células vivas), osteoinducción (factores de inducción ósea) y osteoinducción (andamiaje). El hueso autógeno, especialmente la parte esponjosa, se ha considerado ampliamente el “estándar de oro” del material de injerto, ya que contiene la tríada completa. Sin embargo, los problemas asociados con la adquisición de material autógeno, la necesidad de un segundo sitio quirúrgico y la morbilidad potencial asociada, así como la incapacidad frecuente para recolectar suficiente suministro, han llevado a la búsqueda de materiales alternativos.
Hay muchos materiales en uso: un hospedero de formas sintéticas, así como aloinjertos y xenoinjertos. Todos estos materiales actúan como matrices para el crecimiento de células osteoprogenitoras, lechos vasculares y tejidos perivasculares del lecho receptor circundante. Froum hizo una comparación histológica de cristal bioactivo y aloinjerto óseo liofilizado (DFDBA) en conectores de extracción de cicatrización. Después de 6-8 meses las diferencias en el porcentaje de hueso vital no fue estadísticamente significativa, pero el material de implante residual fue significativamente mayor en los conectores tratados con DFDBA (13.5%) frente a los tratados con biocristal (5.5%). Otro estudio de conector de extracción humano por Carmagnola(8), investigó la cicatrización con el uso de xenoinjerto Bio-Oss, o una membrana reabsorbible sola (Bio-Gide). Al momento de la colocación del implante, el grupo de Bio-Gide mostró grandes cantidades de hueso lamelar y médula ósea y pequeñas porciones de tejido óseo. Los sitios de Bio-Oss estuvieron comprendidos por tejido conectivo y solo cerca del 40% de la circunferencia de las partículas en contacto con el tejido óseo nuevo formado. En un estudio clínico e histológico muy reciente de conector postextracción por Candaropoli, el análisis histológico a los 4 meses reveló formación de hueso nuevo en todos los sitios con un promedio de 25% de partículas de injerto residual. El material estudiado en este reporte es un mineral óseo natural anorgánico de origen bovino. Se produce usando un proceso de extracción química de relativamente bajo calor, resultando en una matriz osteoconductiva efectiva que mantiene su arquitectura trabecular y su porosidad. Las comparaciones mostradas en la Tabla 1 dejan claro que desde el punto de vista de las diversas características físicas, este ABBM es muy similar al hueso esponjoso humano. En particular, la arquitectura trabecular abierta de ABBM, y el hueso esponjoso humano, mejora la estabilización del coágulo y la posterior revascularización del sitio de injerto. La red abierta de trabéculas aumenta una gran cantidad de área de superficie interna y alta porosidad. Esto permite a las células progenitoras migrar fácilmente a través del sitio y eventualmente permitir a los osteoblastos establecer hueso nuevo.
El hueso humano se caracteriza por relativamente pequeños cristales de apatita, como este ABBM. Este tipo de estructura cristalina compacta es importante, ya que los osteoclastos en la matriz ósea serán necesarios al final para reabsorber estos cristales, para iniciar el procesamiento de remodelación. Si la estructura de cristal del material de injerto es significativamente diferente de la del hueso humano, el material de injerto puede finalmente no tener éxito en ser apropiadamente remodelado y reemplazado por nuevo hueso huésped.
Se sabe desde hace tiempo que el mineral óseo humano es depositado como cristales de apatita de carbonato, conteniendo un poco más de 5% de carbonato, 5-10% de fosfato de hidrógeno, así como otros minerales diversos. La apatita biológica se deposita más rápidamente que los cristales de hidroxiapatita sintética en el material de injerto que contiene calcio. Esta unión sirve como un sustrato para posterior unión de célula ósea y proteína. Esta evidencia sugeriría que el material de injerto que contiene mineral óseo natural se incorporará probablemente más pronto en el hueso hospedero.
La naturaleza biológica de ABBM se ha estudiado en un número de estudios animales y humanos. Schlickewel, usando Bio-Oss®, observó el remodelación del hueso en hueso femoral de conejo en un periodo de 1 año. El análisis de 1 mes a los 12 meses mostró contacto de hueso nuevo con el ABBM incrementándose en el periodo de observación, con una cobertura de 90.8% de hueso del material de injerto después de un año. El análisis histomorfométrico en ese periodo también mostró que la cantidad de Bio-Oss® disminuyó durante ese periodo de tiempo, mientras el hueso nuevo incrementaba, sumando junto el 60% del tejido óseo total. La médula ósea representaba el 40% restante. Boyne, usando un mineral óseo bovino anorgánico poroso en monos rhesus, fue capaz de mostrar que durante el remodelación lento, el área quirúrgica aumentó en densidad ósea. Esto resaltó el posible uso de estos materiales de injerto en áreas de densidad ósea disminuida, como el maxilar posterior, para aumentar el soporte de implantes cargados.
La evidencia histológica de especímenes óseos en estudios animales y clínicos han confirmado las propiedades osteoconductoras de ABB. En el presente estudio, la evidencia histológica muestra actividad osteoblástica activa, con estas células alineándose y creando el proceso de mineralización. El nuevo osteoide cubre el ABBM, interconectando las partículas. Esto lleva al puenteo por el hueso nuevo y la estabilización del hueso huésped. En la histomorfometría de este estudio, el porcentaje de volumen de hueso nuevo generado cae dentro de los valores observados en estudios de volúmenes óseos en otros estudios. Trisi y Rao en un estudio de 1999, correlacionaron una evaluación clínica a mano de calidad ósea con la estructura histológica cuantificada por evaluación histomorfométrica de densidad ósea. Los resultados se expresaron como porcentaje de trabécula ósea sobre área de biopsia total, y variaron de 76.5% ± 16.19 en densidad D1 con 28.28% ± 12.02 para D4. Sin embargo, puede haber gran variabilidad en este volumen óseo trabecular, con valores tan altos como 51.93% y tan bajos como 6.73%, con promedios de 17.1% para hembras y 23.4% para machos. Los resultados de este estudio muestran que las características biológicas y fisicoquímicas del ABBM, NuOss™, permite la formación de hueso nuevo vital bien vascularizado en contacto íntimo con las partículas ABBM.
RECONOCIMIENTOS
Este proyecto fue apoyado por Ace Surgical, Brockton, MA. Los autores reconocen con agradecimiento la asistencia de Hari Prasad, científico investigador senior, laboratorio de investigación de tejidos sólidos, facultad de odontología de la universidad de Minnesota, y al Dr. Michel Asad, líder de plataforma, centro de investigación en hueso y periodontal, universidad de McGill, y su equipo técnico, por la preparación de las muestras y el análisis histomorfométrico.
FUENTE
TITANIO
THE INTERNATIONAL JOURNAL OF DENTAL IMPLANTS & BIOMATERIALS